Как правильно расставлять коэффициенты в химии. Карточка-информатор
Преподаватель, являясь главным действующим лицом в организации познавательной деятельности учащихся, постоянно находится в поиске путей повышения эффективности обучения. Организация эффективного обучения возможна только при знании и умелом использовании разнообразных форм педагогического процесса.
1. Современный человек должен обладать, не только суммой знаний и умений, но и способностью воспринимать мир как единое, сложное, постоянно развивающееся целое.
Скачать:
Предварительный просмотр:
Статья по химии: «Расстановка коэффициентов в химических уравнениях»
Составила: учитель химии
ГБОУ СОШ № 626
Казутина О.П.
Москва 2012
«Расстановка коэффициентов в химических уравнениях»
Преподаватель, являясь главным действующим лицом в организации познавательной деятельности учащихся, постоянно находится в поиске путей повышения эффективности обучения. Организация эффективного обучения возможна только при знании и умелом использовании разнообразных форм педагогического процесса.
1. Современный человек должен обладать, не только суммой знаний и умений, но и способностью воспринимать мир как единое, сложное, постоянно развивающееся целое.
Алгоритм работы по подготовке к проведению урока
выбор темы, определение целеполагания;
отбор содержания;
определение средств и путей развития у учащихся положительной мотивационной установки к работе на уроке;
конкретизация оснащения урока необходимым наглядным и дидактическим материалом;
разработка конспекта урока
Пример урока химии «Расстановка коэффициентов в химическом уравнении» для учителей
Цель: ответить на вопрос: «для чего надо расставлять коэффициенты в химическом уравнении»
Задачи:
Проблема необходимости расстановки коэффициентов
Алгоритм расстановки коэффициентов
Доказательство смысла расстановки коэффициентов
Ход урока:
Современный ученик, если он и учится, то относится к получаемым и перерабатываемым знаниям с прагматичностью. Поэтому предоставляемый материал должен уложиться в голове логично и лаконично.
Чтобы этого добиться, учителю всегда следует обращать внимание на то, зачем надо усвоить на уроке то или иное действие. То есть учитель должен объяснить. А потом, по – хорошему, дождаться правильных вопросов по новой теме.
Закон сохранения массы веществ
Знаменитый английский химик Р. Бойль, прокаливая в открытой реторте различные металлы и взвешивания их до и после нагревания, обнаружил, что масса металлов становится больше. Основываясь на этих опытах, он не учитывал роль воздуха и сделал неправильный вывод, что масса веществ в результате химических реакций изменяется. Р. Бойль утверждал, что существует какая-то "огненная материя", которая в случае нагревания металла соединяется с металлом, увеличивая массу.
Mg + O 2 MgO
24 г
40 г
М. В. Ломоносов в отличие от Р. Бойля прокаливал металлы не на открытом воздухе, а в запаянных ретортах и взвешивал их до и после прокаливания. Он доказал, что масса веществ до и после реакции остается без изменения и что при прокаливании к металлу присоединяется какая-то часть воздуха. (Кислород в то время не был еще открыт.) Результаты этих опытов он сформулировал в виде закона: "Все перемены,в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается столько присовокупится к другому". В настоящее время этот закон формулируется так:
Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ
Mg + O 2 MgO
24 г 32 г 40 г
Вопрос: закон не выполняется (т.к. не равны массы исходных и конечных веществ).
Решение этой проблемы – расстановка коэффициентов (целых чисел, показывающих количество молекул):
2Mg + O 2 2MgO
48 г 32 г 80 г – массы до и после равны благодаря тому, что число атомов элементов тоже равно до и после реакции.
Таким образом, доказав учащимся необходимость уравнивания масс коэффициентов, можно даже обойтись без некоторых предыдущих тем: составления формул веществ по валентности, расчета массы, количество вещества…Также рассказ о том, что закон сохранения массы вещества 20 лет спустя «переоткрыл» А. Лавуазье, уточнив его с одной стороны, но совершенно не обратив внимания на М.В. Ломоносова с этической, можно оставить на самостоятельное изучение в виде доклада, например.
Итак, для успешного выполнения заданий такого рода, необходимо усвоить условие: число атомов до реакции дб равно числу атомов после реакции: решим вместе:
H 2 S + 3O 2 SO 2 + 2H 2 O (удваиваем кислороды справа. Считаем их слева)
СН 4 + 2О 2 СО 2 + 2Н 2 О
Мы расставили коэффициенты в уравнениях горения двух газов
Для того чтобы выяснить, как уравнять химическое уравнение, для начала следует узнать предназначение данной науки.
Определение
Химия изучает вещества, их свойства, а также превращения. В случае если не наблюдается изменения окраски, выпадения осадка, выделения газообразного вещества, то не происходит никакого химического взаимодействия.
Например, при обработке напильником железного гвоздя металл просто превращается в порошок. В этом случае никакой химической реакции не происходит.
Прокаливание перманганата калия сопровождается образованием оксида марганца (4), выделением кислорода, то есть наблюдается взаимодействие. При этом возникает вполне закономерный вопрос о том, как правильно уравнивать химические уравнения. Разберем все нюансы, связанные с подобной процедурой.

Специфика химических превращений
Любые явления, которые сопровождаются изменением качественного и количественного состава веществ, относятся к химическим превращениям. В молекулярном виде процесс сгорания железа в атмосфере можно выразить с помощью знаков и символов.
Методика расстановки коэффициентов
Как уравнивать коэффициенты в химических уравнениях? В курсе химии средней школы разбирается метод электронного баланса. Рассмотрим процесс более подробно. Для начала в исходной реакции необходимо расставить степени окисления у каждого химического элемента.
Существуют определенные правила, по которым их можно определить у каждого элемента. В простых веществах степени окисления будут равны нулю. В бинарных соединениях у первого элемента она положительна, соответствует высшей валентности. У последнего данный параметр определяется путем вычитания номера группы из восьми и имеет знак «минус». В формулах, состоящих их трех элементов, есть свои нюансы вычисления степеней окисления.
Для первого и последнего элемента порядок аналогичен определению в бинарных соединениях, а для вычисления центрального элемента составляется уравнение. Сумма всех показателей должна быть равна нулю, исходя из этого, вычисляется показатель для среднего элемента формулы.
Продолжим разговор о том, как уравнивать химические уравнения методом электронного баланса. После того как степени окисления будут поставлены, можно определять те ионы либо вещества, которые в ходе химического взаимодействия изменили их значение.
Знаками «плюс» и «минус» необходимо указать количество электронов, которые были приняты (отданы) в процессе химического взаимодействия. Между полученными цифрами находят наименьшее общее кратное.
При делении его на принятые и отданные электроны получают коэффициенты. Как уравнять химическое уравнение? Полученные в балансе цифры нужно поставить перед соответствующими формулами. Обязательным условием является проверка количества каждого элемента в левой и правой части. Если коэффициенты расставлены правильно, их число должно быть одинаковым.

Закон сохранения массы веществ
Рассуждая над тем, как уравнять химическое уравнение, необходимо использовать именно этот закон. Учитывая, что масса тех веществ, которые вступили в химическую реакцию, равна массе образующихся продуктов, становится возможным постановка коэффициентов перед формулами. Например, как уравнять химическое уравнение, если вступают во взаимодействие простые вещества кальций и кислород, а после завершения процесса получается оксид?
Чтобы справиться с поставленной задачей, необходимо учитывать, что кислород является двухатомной молекулой с ковалентной неполярной связью, поэтому его формула записывается в следующем виде - О2. В правой части при составлении оксида кальция (СаО) учитывают валентности каждого элемента.
Сначала необходимо проверить количество кислорода в каждой части уравнения, так как оно отличается. По закону сохранения массы веществ перед формулой продукта нужно поставить коэффициент 2. Далее проводится проверка кальция. Для того чтобы он был уравнен, перед исходным веществом ставим коэффициент 2. В итоге получаем запись:
- 2Са+О2=2СаО.

Разбор реакции методом электронного баланса
Как уравнивать химические уравнения? Примеры ОВР помогут ответить на данный вопрос. Допустим, что необходимо методом электронного баланса расставить коэффициенты в предложенной схеме:
- CuO + Н2=Cu + Н2О.
Для начала у каждого из элементов в исходных веществах и продуктах взаимодействия расставим значения степеней окисления. Получим следующий вид уравнения:
- Cu(+2)О(-2)+Н2(0)=Cu(0)+Н2(+)О(-2).
Показатели изменились у меди и водорода. Именно на их основе будем составлять электронный баланс:
- Cu(+2)+2е=Cu(0) 1 восстановитель, окисление;
- Н2(0)-2е=2Н(+) 1 окислитель, восстановление.
Исходя из коэффициентов, полученных в электронном балансе, получаем следующую запись предложенного химического уравнения:
- CuO+Н2=Cu+Н2О.
Возьмем еще один пример, который предполагает постановку коэффициентов:
- Н2+О2=Н2О.
Для того чтобы уравнять на основе закона сохранения веществ данную схему, необходимо начать с кислорода. Учитывая, что вступала в реакцию двухатомная молекула, перед формулой продукта взаимодействия необходимо поставить коэффициент 2.
- 2Н2+О2=2Н2О.

Заключение
На основании электронного баланса можно расставлять коэффициенты в любых химических уравнениях. Выпускникам девятых и одиннадцатых классов образовательных учреждений, выбирающим экзамен по химии, в одном из заданий итоговых тестов предлагают подобные задания.
В уроке 13 «» из курса «Химия для чайников » рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
В результате реакции горения метана CH 4 в кислороде O 2 образуются диоксид углерода CO 2 и вода H 2 O. Эта реакция может быть описана химическим уравнением :
- CH 4 + O 2 → CO 2 + H 2 O (1)
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O 2 расходуется в расчете на 1 молекулу CH 4 и сколько молекул CO 2 и H2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
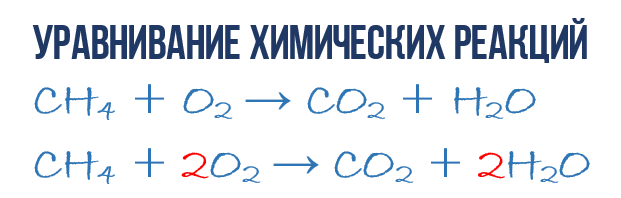
Начнем с углерода. В левой части один атом С входит в состав молекулы CH 4 , а в правой части один атом С входит в состав CO 2 . Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H 4 = 4H) в составе молекулы CH 4 , а в правой – всего 2 атома H в составе молекулы H 2 O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H 2 O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H 2 O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H 2 O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O или СH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C 7 H 5 N 3 O 6 энергично соединяется с кислородом, образуя H 2 O, CO 2 и N 2 . Запишем уравнение реакции, которое будем уравнивать:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O 2 . Таким образом полное химическое уравнение будет иметь вид:
- 2C 7 H 5 N 3 O 6 + 10,5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты , а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро N A =6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O 2 с образованием 28 молей CO 2 , 10 молей H 2 O и 6 молей N 2 .
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O2 = 31,999 г/моль
- CO2 = 44,010 г/моль
- H2 O = 18,015 г/моль
- N2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO 2 , 10·18,015 г = 180,15 г H 2 O и 6·28,013 г = 168,08 г N 2 . Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO2 | |
| 671,98 г CO2 | 180,15 г H2 O | |
| 168,08 г N2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2 :
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO 3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 . Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO 3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl 2 (110,99 г/моль), CO 2 (44,01 г/моль) и H 2 O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO 3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
- CaCO 3 (тв.) + 2H + (водн.) → Ca 2+ (водн.) + CO 2 (г.) + H 2 O(ж.) (12)
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO 3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO 2 и H 2 O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений » вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
РАССТАНОВКА КОЭФФИЦИЭНТОВ
Число атомов одного элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части уравнения.
Задание 1 (для групп). Определите число атомов каждого химического элемента, участвующего в реакции.
1. Вычислите число атомов:
а) водорода: 8NH3, NaOH, 6NaOH, 2NaOH, НзРО4, 2H2SO4, 3H2S04, 8H2SO4;
6) кислорода : C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Вычислите число атомов: а) водорода:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
б) кислорода:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Алгоритм расстановки коэффициентов в уравнениях химических реакций
А1 + О2→ А12О3А1-1 атом А1-2
О-2 атома О-3
2. Среди элементов с разным числом атомов в левой и правой частях схемы выбрать тот, число атомов которого больше
О-2 атома слева
О-3 атома справа
3. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения
НОК = 6
4. Разделить НОК на число атомов этого элемента в левой части уравнения, получить коэффициент для левой части уравнения
6:2 = 3
Аl + ЗО 2 →Аl 2 О 3
5. Разделить НОК на число атомов этого элемента в правой части уравнения, получить коэффициент для правой части уравнения
6:3 = 2
А1+ О 2 →2А1 2 О3
6. Если выставленный коэффициент изменил число атомов еще какого-либо элемента, то действия 3, 4, 5 повторить еще раз.
А1 + ЗО 2 → →2А1 2 О 3
А1 -1 атом А1 - 4
НОК = 4
4:1=4 4:4=1
4А1 + ЗО 2 → →2А1 2 О 3
. Первичная проверка усвоения знаний(8-10 мин .).
В левой части схемы два атома кислорода, а в правой - один. Число атомов нужно выровнять с помощью коэффициентов.
1)2Mg+O 2 →2MgO
2) СаСО 3 + 2HCl→ СаСl 2 + Н 2 О + СО 2
Задание 2 Расставьте коэффициенты в уравнениях химических реакций (обратите внимание, что коэффициент изменяет число атомов только одного элемента ):
1. Fe 2 O 3 + А l → А l 2 О 3 + Fe; Mg + N 2 → Mg 3 N 2 ;
2. Al + S → Al 2 S 3 ; A1 + С → Al 4 C 3 ;
3. Al + Cr 2 O 3 → Cr + Al 2 O 3 ; Ca + P → Ca 3 P 2 ;
4. С + H 2 → CH 4 ; Ca + С → СаС 2 ;
5. Fe + O 2 → Fe 3 O 4 ; Si + Mg → Mg 2 Si;
6/.Na + S → Na 2 S; CaO + С → CaC 2 + CO;
7. Ca + N 2 → C a 3 N 2 ; Si + Cl 2 → SiCl 4 ;
8. Ag + S → Ag 2 S; Н 2 + С l 2 → НС l;
9. N 2 + O 2 → NO; СО 2 + С → СО ;
10. HI → Н 2 → + 1 2 ; Mg + НС l → MgCl 2 + Н 2 ;
11. FeS + НС 1 → FeCl 2 + H 2 S; Zn+ HCl → ZnCl 2 + H 2 ;
12. Br 2 + KI → KBr+ I 2 ; Si + HF (r) → SiF 4 + H 2 ;
1./ HCl+Na 2 CO 3 → CO 2 +H 2 O+ NaCl; KClO 3 + S → → KCl+ SO 2 ;
14. Cl 2 + KBr → KCl + Br 2 ; SiO 2 + С → Si + CO;
15. SiO 2 + С → SiC + CO; Mg + SiO 2 → Mg 2 Si + MgO
16 .
3.Что означает знак «+» в уравнении?
4. Зачем расставляют коэффициенты в уравнениях хим
Инструкция
Прежде чем приступать к самому заданию, нужно усвоить, что цифра, которая ставится перед химическим элементом или всей формулой коэффициентом. А цифра, стоящая (и чуть ) индекс. Кроме этого , что:
Коэффициент относится ко всем химическим символам, стоящим после него в формуле
Коэффициент умножается на индекс (не складывается!)
Атомов каждого элемента вступающих в реакцию веществ должно совпадать с числом атомов этих элементов, входящих в продуктов реакции.
Например, запись формулы 2H2SO4 означает 4 атома H (водорода), 2 атома S (серы) и 8 атомов O (кислорода).
1. Пример № 1. Рассмотрим горения этилена.
При сгорании органического вещества образуются оксид углерода (IV) (углекислый газ) и вода. Попробуем последовательно коэффициенты.
C2H4 + O2 => CO2+ H2O
Начинаем анализировать. В реакцию в ступило 2 атома С (углерода), а получился только 1 атом, значит перед CO2 ставим 2. Теперь их количество одинаково.
C2H4 + O2 => 2CO2+ H2O
Теперь смотрим на H (водород). В реакцию вступило 4 атома водорода, а получилось в результате только 2 атома, следовательно, перед H2O (водой) ставим 2 – теперь получилось тоже 4
C2H4 + O2 => 2CO2+ 2H2O
Считаем все атомы О (кислорода), образовавшиеся в результате реакции (то есть, после равенства). 4 атома в 2CO2 и 2 атома в 2H2O – всего 6 атомов. А до реакции всего 2 атома, значит, перед молекулой кислорода O2 ставим 3, а значит, их стало тоже 6.
C2H4 + 3O2 => 2CO2+ 2H2O
Таким образом, получилось одинаковое количество атомов каждого элемента до и после знака равенства.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Пример № 2. Рассмотрим реакцию взаимодействия алюминия с разбавленной серной кислотой.
Al + H2SO4 => Al2 (SO4) 3 + H2
Смотрим на атомы S, входящие в состав Al2 (SO4) 3 - их 3, а в H2SO4 (серной кислоте) только 1, следовательно, и перед серной кислотой тоже ставим 3.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Зато теперь получилось до реакции 6 атомов H (водорода), а после реакции только 2, значит, перед молекулой H2 (водорода) ставим тоже 3, чтобы в целом получилось 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
В последнюю очередь смотрим на . Так как в Al2 (SO4) 3 (сульфате алюминия) всего 2 атома алюминия, то и до реакции перед Al (алюминием) ставим 2.
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Теперь количество всех атомов до и после реакции совпадает. Оказалось, что расставлять коэффициенты в химических уравнениях не так и сложно. Достаточно потренироваться и все получится.
Полезный совет
Обязательно учитывайте, что коэффициент умножается на индекс, а не складывается.
Источники:
- как элементы вступают в реакцию
- Тест по теме «Химические уравнения»
Для многих школьников написать уравнения химических реакций и правильно расставить коэффициенты нелегкая задача. Причем, главную трудность у них почему-то вызывает именно вторая ее часть. Казалось бы, ничего сложного в том нет, однако порой ученики пасуют, впадая в полную растерянность. А ведь надо всего лишь запомнить несколько простых правил, и задача перестанет вызывать затруднения.
Инструкция
Коэффициент, то есть число, стоящее перед формулой молекулы химического вещества, ко всем символам, и умножается на каждый каждого символа! Именно умножается, а не складывается! Это может показаться невероятным, но некоторые школьники складывают два числа вместо того, чтобы их перемножить.
Количество атомов каждого элемента исходных веществ (то есть находящихся в левой части уравнения) должно совпадать с количеством атомов каждого элемента продуктов реакции (соответственно, находящихся в его правой части).






