Ugljični monoksid s metalima. Fizikalna svojstva ugljičnog monoksida: gustoća, toplinski kapacitet, toplinska vodljivost CO
Empirijska formula. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . CO
Molekularna težina, kg/kmol. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..28.01
Agregatno stanje. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . plinoviti
Izgled. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .bezbojni plin
Miris. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . bez mirisa.
Primjena: kao jedan od polaznih spojeva na kojima se temelji moderna industrija organske sinteze. Koristi se za redukciju metala iz oksida, za proizvodnju metalnih karbonila, fosgena, ugljikovog sulfida, aluminijevog klorida, metilnog alkohola, formamida, aromatskih aldehida, mravlje kiseline itd.
FIZIČKO-KEMIJSKE KARAKTERISTIKE
Gustoća pri 0 °C i tlaku 101,3 kPa, kg/m3. . . . . . . . . . . . . . . . . . . . . 1,250
Gustoća pri 20 °C i tlaku 101,3 kPa, kg/m3. . . . . . . . . . . . . . . . . . . . 1.165
Vrelište, °C. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . minus 192
Talište pri tlaku 101,3 kPa, °C. . . . . . . . . . . .minus 205
Kritična temperatura, °C. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . minus 138,7
Kritični tlak, MPa. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.5
Toplina izgaranja, kJ/mol. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . minus 283
Specifična toplina izgaranja, kJ/mol. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10107
Toplina stvaranja, kJ/mol. . . . . . . . . . . . . . . . . . . . . . . . . . . . . minus 110,5
Toplinski kapacitet plina pri 0°C i stalnom tlaku, kJ/(kg? deg). . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1,0416
Toplinski kapacitet plina pri 0°C i konstantnom volumenu, kJ/(kg? deg). . . .0,7434
Dinamička viskoznost, N?s/m2. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 166.04?107
Kinematička viskoznost, m2/s. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13.55?106
Koeficijent toplinske vodljivosti plina pri 0°C i tlaku 101,3 kPa, W/(m? K). . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,0233
:*t - čvrsta tvar.
Topivost u vodi: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . topljiv
Reaktivnost: relativno dobro topljiv, osobito pod tlakom, u otopinama diklorometana (CH2Cl2), amonijevog hidroksida i klorovodične kiseline. Na niskim temperaturama ugljikov monoksid je prilično inertan; na visokim razinama, lako ulazi u razne reakcije, posebno reakcije adicije. Ima obnavljajuća svojstva.
Oksidira u CO2 na sobnoj temperaturi.
SANITARNO HIGIJENSKE KARAKTERISTIKE
CAS registracijski broj. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 630-08-0
MPCm.r. u zraku radnog prostora, mg/m3. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 20*
Šifra onečišćivača zraka: . . . . . . . . . . . . . . . . .0337
Klasa opasnosti u atmosferskom zraku. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4
MPCm.r./s.s. u atmosferskom zraku, mg/m3. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5/3
* - Pri radu u atmosferi koja sadrži ugljični monoksid ne dulje od 1 sata, najveća dopuštena koncentracija ugljičnog monoksida može se povećati na 50 mg/m3, pri radu ne duljem od 30 minuta. – do 100 mg/m3, s trajanjem rada ne više od 15 minuta. – 200 mg/m3. Ponovni rad u uvjetima visokog sadržaja ugljičnog monoksida u zraku radnog prostora može se izvoditi uz pauzu od najmanje 2 sata.
Utjecaj na ljude: otrovna tvar, odnosi se na tvari s visoko usmjerenim mehanizmom djelovanja, zahtijeva automatsku kontrolu sadržaja u zraku. Toksičan učinak na središnji živčani sustav.
Mjere prve pomoći žrtvama izloženosti tvari: svježi zrak, skinuti odjeću koja ometa disanje, odmor, zagrijavanje. Teška i srednje teška trovanja liječe se u bolnici.
Mjere opreza: potrebni su lokalni odsisni uređaji i opća ventilacija prostorija. Brtvljenje opreme i komunikacija. Stalno praćenje koncentracije u zraku radnog prostora, korištenje automatskih instrumenata i alarmnih uređaja.
Sredstva zaštite: . . . . . . . . . . . . . . . . . . . . . . . . . . . filter gas maska.
POŽARNO-EKSPLOZIJSKA SVOJSTVA
Grupa zapaljivosti. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . zapaljivi plin (GG)
Temperatura samozapaljenja, °C. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 605
Koncentracijske granice širenja plamena, % (vol.). . 12.5-74 (prikaz, ostalo).
Minimalni eksplozivni sadržaj kisika, % (vol.) kada je razrijeđen:
Dušik. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.6
Ugljični dioksid. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.9
Maksimalni tlak eksplozije, kPa. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 730
Sigurni eksperimentalni maksimalni razmak, mm. . . . . . . . . . 0,84
Grupa eksplozivnih smjesa prema GOST R 51330.5. . . . . . . . . . . . . . . . . . . . . . . T1
Oprema za gašenje požara: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . inertni plinovi.
Ugljikovi oksidi
Posljednjih se godina u pedagogiji daje prednost učenju usmjerenom na osobnost. Formiranje individualnih osobina ličnosti događa se u procesu aktivnosti: učenje, igra, rad. Stoga je važan čimbenik učenja organizacija procesa učenja, priroda odnosa između nastavnika i učenika i učenika među sobom. Na temelju tih ideja nastojim na poseban način graditi obrazovni proces. Istovremeno, svaki student bira vlastiti tempo proučavanja gradiva, ima priliku raditi na njemu dostupnoj razini, u situaciji uspjeha. U nastavi je moguće svladati i poboljšati ne samo predmetne, već i općeobrazovne vještine kao što su postavljanje obrazovnog cilja, odabir sredstava i načina za njegovo postizanje, praćenje vlastitih postignuća i ispravljanje pogrešaka. Učenici uče raditi s literaturom, praviti bilješke, dijagrame, crteže, raditi u grupi, u paru, individualno, konstruktivno razmjenjivati mišljenja, logički zaključivati i zaključivati.
Održavanje takvih lekcija nije lako, ali ako uspijete, osjećate zadovoljstvo. Nudim skriptu za jednu od svojih lekcija. Prisustvovali su mu kolege, uprava i psiholog.
Vrsta lekcije. Učenje novog gradiva.
Ciljevi. Na temelju motivacije i obnavljanja temeljnih znanja i vještina učenika razmotriti strukturu, fizikalna i kemijska svojstva, proizvodnju i korištenje ugljičnog dioksida i ugljičnog dioksida.
Članak je pripremljen uz podršku web stranice www.Artifex.Ru. Ako odlučite proširiti svoje znanje na području suvremene umjetnosti, onda bi najbolje rješenje bilo posjetiti web stranicu www.Artifex.Ru. Kreativni almanah ARTIFEX omogućit će vam upoznavanje s djelima suvremene umjetnosti bez napuštanja doma. Detaljnije informacije možete pronaći na web stranici www.Artifex.Ru. Nikada nije kasno da počnete širiti svoje horizonte i osjećaj za lijepo.
Oprema i reagensi. Kartice “Programirano istraživanje”, poster dijagram, uređaji za proizvodnju plinova, čaše, epruvete, aparat za gašenje požara, šibice; vapnena voda, natrijev oksid, kreda, klorovodična kiselina, otopine indikatora, H 2 SO 4 (konc.), HCOOH, Fe 2 O 3.
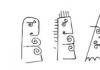
Poster dijagram
“Struktura molekule ugljičnog monoksida (ugljikov monoksid (II)) CO”
TIJEKOM NASTAVE
Stolovi za učenike u kabinetu raspoređeni su u krug. Nastavnik i učenici imaju mogućnost slobodnog kretanja za laboratorijskim stolovima (1, 2, 3). Tijekom nastave djeca sjede za stolovima (4, 5, 6, 7, ...) jedni s drugima po želji (slobodne grupe od 4 osobe).

Učitelj, nastavnik, profesor. Mudra kineska poslovica(lijepo napisano na ploči) glasi:
"Čujem - zaboravim,
Vidim - sjećam se
Da - razumijem.”
Slažete li se sa zaključcima kineskih mudraca?
Koje ruske poslovice odražavaju kinesku mudrost?
Djeca daju primjere.
Učitelj, nastavnik, profesor. Doista, samo stvaranjem može se dobiti vrijedan proizvod: nove tvari, uređaji, strojevi, kao i nematerijalne vrijednosti – zaključci, generalizacije, zaključci. Pozivam vas danas da sudjelujete u istraživanju svojstava dviju tvari. Poznato je da prilikom tehničkog pregleda automobila vozač daje potvrdu o stanju ispušnih plinova automobila. Koja je koncentracija plina navedena u potvrdi?
(O t v e t. PA.)
Student. Ovaj plin je otrovan. Nakon što uđe u krv, uzrokuje trovanje tijela ("pečenje", otuda i naziv oksida - ugljični monoksid). Nalazi se u ispušnim plinovima automobila u količinama opasnim po život.(čita reportažu iz novina o vozaču koji je zaspao u garaži dok je motor radio i umro). Protuotrov za trovanje ugljičnim monoksidom je udisanje svježeg zraka i čistog kisika. Drugi ugljikov monoksid je ugljikov dioksid.
Učitelj, nastavnik, profesor. Na vašim stolovima nalazi se kartica "Programirana anketa". Upoznajte se s njegovim sadržajem i na praznom papiru označite brojeve onih zadataka za koje znate odgovore na temelju svog životnog iskustva. Nasuprot broju tvrdnje zadatka napišite formulu ugljičnog monoksida na koju se ova tvrdnja odnosi.
Studenti savjetnici (2 osobe) prikupljaju listove s odgovorima i na temelju rezultata odgovora formiraju nove grupe za daljnji rad.
Programirano istraživanje “Ugljični oksidi”
1. Molekula ovog oksida sastoji se od jednog atoma ugljika i jednog atoma kisika.
2. Veza između atoma u molekuli je polarna kovalentna.
3. Plin koji je praktički netopljiv u vodi.
4. Molekula ovog oksida sadrži jedan atom ugljika i dva atoma kisika.
5. Nema mirisa ni boje.
6. Plin topiv u vodi.
7. Ne pretvara se u tekućinu čak ni na –190 °C ( t kip = –191,5 °C).
8. Kiseli oksid.
9. Lako se sabija, na 20 °C pod pritiskom od 58,5 atm postaje tekuć i stvrdnjava se u „suhi led”.
10. Nije otrovno.
11. Ne stvara sol.
12. Zapaljivo
13. Interakcija s vodom.
14. Interakcija s bazičnim oksidima.
15. Reagira s metalnim oksidima, reducirajući slobodne metale iz njih.
16. Dobiva se reakcijom kiselina sa solima ugljične kiseline.
17. ja
18. Interakcija s alkalijama.
19. Izvor ugljika koji biljke apsorbiraju u staklenicima i staklenicima dovodi do povećanja prinosa.
20. Koristi se za gaziranje vode i pića.
Učitelj, nastavnik, profesor. Ponovno pregledajte sadržaj kartice. Grupirajte informacije u 4 bloka:
struktura,
fizička svojstva,
Kemijska svojstva,
primanje.
Nastavnik svakoj grupi učenika daje priliku za govor i sažima izlaganja. Zatim učenici različitih skupina biraju svoj plan rada – redoslijed proučavanja oksida. U tu svrhu oni numeriraju blokove informacija i obrazlažu svoj izbor. Redoslijed učenja može biti kao što je gore napisano ili s bilo kojom drugom kombinacijom četiri označena bloka.
Nastavnik skreće pozornost učenika na ključne točke teme. Budući da su ugljikovi oksidi plinovite tvari, s njima se mora pažljivo rukovati (sigurnosne upute). Nastavnik odobrava plan za svaku grupu i dodjeljuje konzultante (unaprijed pripremljene studente).
Demonstracijski pokusi
1. Prelijevanje ugljičnog dioksida iz čaše u čašu.
2. Gašenje svijeća u čaši dok se CO 2 akumulira.
3. Stavite nekoliko malih komadića suhog leda u čašu vode. Voda će proključati i iz nje će se izbijati gusti bijeli dim.
Plin CO 2 se ukapljuje već na sobnoj temperaturi pod tlakom od 6 MPa. U tekućem stanju skladišti se i transportira u čeličnim cilindrima. Ako otvorite ventil takvog cilindra, tekući CO 2 će početi isparavati, zbog čega dolazi do snažnog hlađenja i dio plina se pretvara u snježnu masu - "suhi led", koji se preša i koristi za skladištenje sladoled.
4. Demonstracija aparata za gašenje požara kemijskom pjenom (CFO) i objašnjenje principa njegova rada pomoću modela – epruvete s čepom i cijevi za odvod plina.

Informacije na struktura na tablici br. 1 (instruktivne kartice 1 i 2, struktura molekula CO i CO 2 ).
Informacije o fizička svojstva– za tablicom br. 2 (rad s udžbenikom – Gabrielyan O.S. Kemija-9. M.: Bustard, 2002, str. 134–135).
Podaci o pripremi i kemijskim svojstvima– na tablicama br. 3 i 4 (nastavne kartice 3 i 4, upute za praktični rad, str. 149–150 udžbenika).
Praktični rad Stavite nekoliko komadića krede ili mramora u epruvetu i dodajte malo razrijeđene klorovodične kiseline. Brzo zatvorite cijev čepom i cijevi za odvod plina. Stavite kraj epruvete u drugu epruvetu koja sadrži 2-3 ml vapnene vode. Gledajte nekoliko minuta kako mjehurići plina prolaze kroz vapnenu vodu. Zatim uklonite kraj cijevi za odvod plina iz otopine i isperite je u destiliranoj vodi. Stavite epruvetu u drugu epruvetu s 2-3 ml destilirane vode i kroz nju propustite plin. Nakon nekoliko minuta izvadite epruvetu iz otopine i u dobivenu otopinu dodajte nekoliko kapi plavog lakmusa. U epruvetu ulijte 2-3 ml razrijeđene otopine natrijevog hidroksida i dodajte nekoliko kapi fenolftaleina. Zatim propustite plin kroz otopinu. Odgovori na pitanja. Pitanja 1. Što se događa kada se kreda ili mramor tretiraju klorovodičnom kiselinom? 2. Zašto se pri propuštanju ugljičnog dioksida kroz vapnenu vodu prvo zamuti otopina, a zatim se vapno otopi? 3. Što se događa kada se ugljikov(IV) monoksid propusti kroz destiliranu vodu? Napišite jednadžbe za odgovarajuće reakcije u molekularnom, ionskom i skraćenom ionskom obliku. Prepoznavanje karbonata Četiri epruvete koje ste dobili sadrže kristalne tvari: natrijev sulfat, cink klorid, kalijev karbonat, natrijev silikat. Odredi koja se tvar nalazi u svakoj epruveti. Napišite jednadžbe reakcije u molekularnom, ionskom i skraćenom ionskom obliku. |
Domaća zadaća
Učitelj predlaže da karticu „Programirana anketa“ ponesete kući i, u pripremi za sljedeću lekciju, razmislite o načinima dobivanja informacija. (Kako ste znali da se plin koji proučavate pretvara u tekućinu, da reagira s kiselinom, da je otrovan itd.?)
Samostalni rad učenika
Grupe djece izvode praktičan rad različitim brzinama. Stoga se igre nude onima koji brže završe posao.
Peti kotač
Četiri tvari mogu imati nešto zajedničko, ali peta supstanca se izdvaja iz niza, suvišna je.
1. Ugljik, dijamant, grafit, karbid, karabin. (Karbid.)
2. Antracit, treset, koks, ulje, staklo. (Staklo.)
3. Vapnenac, kreda, mramor, malahit, kalcit. (Malahit.)
4. Kristalna soda, mramor, potaša, kaustična, malahit. (Kaustično.)
5. Fosgen, fosfin, cijanovodična kiselina, kalijev cijanid, ugljikov disulfid. (fosfin.)
6. Morska voda, mineralna voda, destilirana voda, podzemna voda, tvrda voda. (Destilirana voda.)
7. Vapneno mlijeko, pahuljica, gašeno vapno, vapnenac, vapnena voda. (Vapnenac.)
8. Li2CO3; (NH4)2C03; CaCO3; K2CO3, Na2CO3. (CaCO3.)
Sinonimi
Napiši kemijske formule tvari ili njihove nazive.
1. Halogena -... (Klor ili brom.)
2. Magnezit – ... (MgCO 3.)
3. Urea –... ( Urea H 2 NC(O)NH 2 .)
4. Potaša - ... (K 2 CO 3.)
5. Suhi led - ... (CO 2.)
6. Vodikov oksid –... ( Voda.)
7. Amonijak -... ( 10% vodena otopina amonijaka.)
8. Soli dušične kiseline –... ( Nitrati– KNO 3, Ca(NO 3) 2, NaNO 3.)
9. Prirodni plin – ... ( Metan CH 4.)
antonimi
Napiši kemijske pojmove koji su po značenju suprotni predloženim.
1. Oksidirajuće sredstvo –... ( Reducirajuće sredstvo.)
2. Donator elektrona –… ( Akceptor elektrona.)
3. Svojstva kiseline – ... ( Osnovna svojstva.)
4. Disocijacija –… ( Udruga.)
5. Adsorpcija – ... ( Desorpcija.)
6. Anoda –... ( Katoda.)
7. Anion –… ( Kation.)
8. Metal –… ( Nemetalni.)
9. Polazne tvari –... ( Produkti reakcije.)
Potražite uzorke
Odredite znak koji objedinjuje navedene tvari i pojave.
1. Dijamant, karabin, grafit – ... ( Alotropske modifikacije ugljika.)
2. Staklo, cement, cigla - ... ( Građevinski materijali.)
3. Disanje, truljenje, vulkanska erupcija - ... ( Procesi praćeni oslobađanjem ugljičnog dioksida.)
4. CO, CO 2, CH 4, SiH 4 – ... ( Spojevi elemenata IV skupine.)
5. NaHCO 3, CaCO 3, CO 2, H 2 CO 3 – ... ( Kisikovi spojevi ugljika.)
Podmukla svojstva ugljičnog monoksida poznata su od davnina. Naši preci su znali da je vrlo opasno zatvoriti propuh u nedogoreloj peći uz održavanje topline. U zatvorenoj kući je toplo, ugodno, osoba se odmara - i ne probudi se, izgori.
Krivac nesreće ima različita imena - ugljični monoksid (II), ugljični monoksid, ugljični monoksid, ugljični monoksid, CO.
GDJE NASTAJE UGLJIČNI MONOKSID?
Kada je propuh zatvoren, nastaje tijekom oksidacije tinjajućeg ugljena u uvjetima nedostatka kisika, te ulazi u prostoriju. Ljudi ne primjećuju invaziju - na kraju krajeva, napadač nema ni miris ni boju. No djeluje prije svega na središnji živčani sustav, a uznemirena osoba ne može procijeniti da se s njom nešto loše događa.
Čini se da danas malo ljudi koristi peći, a vjerojatnost susreta s ugljičnim monoksidom je mala. No ispada da se ova tvar oslobađa i kao rezultat ljudske aktivnosti i u mnogim prirodnim procesima.
Ugljični monoksid nastaje pri gotovo svim vrstama izgaranja - kod izgaranja goriva u elektranama i toplanama, kod loženja vatre i plinske peći, u ispušnim plinovima automobila, kod pušenja. Izvori CO su metalurgija i kemijska industrija. Ugljikov monoksid se koristi kao polazni materijal za sintezu acetona, metilnog alkohola, uree itd.
Kao rezultat vulkanske aktivnosti i oksidacije metana, ugljični monoksid također ulazi u atmosferu. Ali količina prirodnog ugljičnog monoksida, prema nekim procjenama, iznosi samo oko 3% plina iz antropogenih izvora, 90% proizvedenog izgaranjem fosilnih goriva.
Jedan od izvora ugljičnog monoksida je i sam čovjek.
Činjenica je da je ugljični monoksid produkt normalnog metabolizma – u malim koncentracijama neophodan je tijelu i u njemu djeluje važne funkcije .
Čovjek izdahne do 10 ml CO dnevno. Ovo je važno imati na umu za programere sustava za pročišćavanje zraka za dugotrajni boravak u zatvorenim prostorima - svemirskim brodovima, kesonima itd.
Tako se može nazvati sveprisutni ugljični monoksid svakodnevni otrov. Njegova najveća dopuštena koncentracija u zraku industrijskih prostora je 20 mg/m3 ili 0,02 mg/l. Prirodna razina CO u zraku je 0,01 - 0,9 mg/m3, a na ruskim autocestama prosječna koncentracija CO kreće se od 6-57 mg/m3, što prelazi prag trovanja.
Glavni "dobavljač" ugljičnog monoksida u velikim gradovima je motorni promet. Pri sagorijevanju 1000 litara goriva vozila u atmosferu ispuštaju 25 do 200 kg ugljičnog monoksida. Na primjer, 72-75% ukupnog ugljičnog monoksida ulazi u atmosferu Moskve krivnjom automobila.
Nažalost, slučajevi trovanja u zatvorenim garažama nisu rijetki.
Ni pod kojim uvjetima ne palite i zagrijavajte motor u zatvorenoj, neprovjetrenoj prostoriji!
GDJE SE AKUMULIRA UGLJIČNI MONOKSID?
Ugljični monoksid može se nakupljati u opasnim koncentracijama ne samo u garaži. Godine 1982. stotine afganistanskih i sovjetskih vojnika poginulo je na prijevoju Salang zbog nesreće u planinskom tunelu dugom više od četiri kilometra. Zbog snježnih padalina mnogi su automobili bili nagomilani s obje strane. U središtu tunela sudarila su se dva automobila zbog čega je nastao zastoj. Vozači nisu gasili motore, povećana je koncentracija ugljičnog monoksida, ljudi su gubili svijest i umrli.
Što se automobil sporije kreće ulicama, što duže stoji s upaljenim motorom ili puževim korakom puže u prometnoj gužvi, emitira više ugljičnog monoksida. A ugljični monoksid jedan je od glavnih zagađivača zraka u velikim gradovima. Stoga je čistoća zraka u velikim gradovima uvelike povezana s organiziranošću prometa. I, naravno, važna je svijest vozača
Ako morate stajati na semaforu ili prijelazu nekoliko minuta, ugasite motor.
Uštedjet ćete benzin i zrak će biti čišći. I ne morate zagrijavati motor usmjeravajući ispušnu cijev prema susjedovom prozoru. Štoviše, motore većine modernih automobila uopće nije potrebno zagrijavati.
Ugljični monoksid se nakuplja u slabo prozračenim dvorištima i u blizini autocesta. Stoga je koncentracija ugljičnog monoksida u krvi stanovnika velikih gradova veća nego kod stanovnika ruralnih područja. Ako je moguće, izbjegavajte hodanje duž prometnih autocesta, osobito s djecom. Odaberite mirnu obližnju ulicu, ili još bolje park. To je osobito važno ako se bavite intenzivnom aktivnošću koja zahtijeva povećani utrošak energije, a time i intenzivnije disanje - biciklizam, rolanje, trčanje ili skijanje.
Takve fizičke vježbe u blizini autoceste donijet će samo štetu.
Međutim, nekima ovaj ugljični monoksid koji nas posvuda vreba nije dovoljan - i oni ga "sustižu" uz pomoć duhanskog dima. Pušač pri pušenju jedne cigarete udahne 18,4 mg CO. Ako toliko ugljičnog monoksida uđe u tijelo odjednom, mogao bi umrijeti. Srećom, dio CO-a napušta tijelo izdisajem. Koncentracija ugljičnog monoksida u krvi pušača u 40 puta prelazi normu!
Pasivno pušenje također je nešto manje opasno. U sat vremena u zadimljenoj prostoriji čovjek udahne oko 9 mg CO2 – toliko bi dobio da sam popuši pola cigarete. Ovo je posebno važno zapamtiti za roditelje koji puše u prisutnosti svoje djece.
UTJECAJ NA TIJELO
Kako ugljikov monoksid utječe na tijelo? Ulazeći u pluća, a odatle u krvnu plazmu, CO prodire u crvena krvna zrnca i tamo stupa u interakciju s proteinom hemoglobinom - prijenosnikom kisika iz pluća u tkiva. Svaka molekula hemoglobina sadrži četiri hem-porfirinska prstena, u čijem se središtu nalazi atom željeza koji može reverzibilno vezati molekulu kisika, tvoreći takozvani oksihemoglobin. Zahvaljujući hemoglobinu, krv može unijeti približno 70 puta više kisika u tkiva nego što bi slana voda unijela samim otapanjem.
Ugljični monoksid cilja na atom željeza, tvoreći složeni spoj (karboksihemoglobin) koji ne može prenositi kisik.
U konkurenciji za hemoglobin, ugljični monoksid ima izrazitu prednost u odnosu na kisik - on brže reagira s hemoglobinom i stvara jači spoj od oksihemoglobina. Osim toga, disocijacija karboksihemoglobina u krvi odvija se vrlo sporo i postupno se nakuplja. Stoga se koncentracija karboksihemoglobina u krvi može opasno povećati pri dugotrajnom udisanju zraka koji sadrži ugljični monoksid u vrlo malim koncentracijama - samo 0,07%. Krv gubi sposobnost prijenosa kisika do tkiva i javljaju se simptomi akutnog nedostatka kisika.
Vidljivi znakovi trovanja javljaju se kada sadržaj karboksihemoglobina u odnosu na ukupni sadržaj hemoglobina u krvi prijeđe 20%. Kod 30% javlja se vrtoglavica, slabost u nogama, smanjena oštrina vida, kod 40-50%, zamućenje svijesti, 60-70% sadržaja karboksihemoglobina dovodi do smrti. Što je veća koncentracija ugljičnog monoksida u zraku, to se brže postiže opasna koncentracija karboksihemoglobina u krvi. Na primjer, udisanje zraka koji sadrži 0,1% ugljikovog monoksida dovodi do razine karboksihemoglobina u krvi od 40% u manje od 3 sata ako osoba miruje. A ako je zauzet teškim radom, pluća se aktivno ventiliraju, a stvaranje karboksihemoglobina se događa brže - na istoj razini.
Kada su male količine ugljičnog monoksida izložene tijelu tijekom dužeg vremenskog razdoblja, karboksihemoglobin je stalno prisutan u krvi. Nema očitih znakova trovanja pri koncentraciji karboksihemoglobina od 2-10%, ali se takve osobe često žale na glavobolje, umor, smanjen apetit, razdražljivost, loš san, bolove u srcu, oslabljeno pamćenje i pažnju. Simptomi poznati mnogim stanovnicima velikih gradova. A stanovnici grada koji puše situaciju dodatno pogoršavaju.
KAKO POMOĆI OTROVANOM UGLJIČNIM MONOKSIDOM
Kako pomoći osobi otrovanoj ugljičnim monoksidom? Prije svega, potrebno je pomoći krvi da se što brže riješi karboksihemoglobina, da se ravnoteža pomakne prema stvaranju spoja hemoglobina s kisikom. I da biste to učinili, čak i prije dolaska ekipe hitne pomoći, odnesite (ili odnesite) žrtvu na svježi zrak.
Povećanje koncentracije kisika u zraku ubrzava uklanjanje karboksihemoglobina iz krvi. Liječnici, primjerice, žrtvi daju udahnuti čisti kisik ili, ako je moguće, kisik pod tlakom u tlačnoj komori, potičući mu disanje lijekovima ili metodama umjetnog disanja. Liječnici u svom arsenalu imaju i druge lijekove za borbu protiv trovanja ugljičnim monoksidom, na primjer, spojeve željeza koji "presreću" CO iz hemoglobina i ubrzavaju njegovo uklanjanje iz tijela.
Što je tijelo dulje u uvjetima gladovanja tkiva kisikom, to su njegove posljedice teže, prvenstveno za srčani mišić i mozak. Stoga izlječenje trenutnog sindroma teškog trovanja ne znači i potpuno ozdravljenje. Često dolazi do oštećenja neurona moždane kore, u 7 od 10 slučajeva nakon trovanja unutar 3 mjeseca mogu se pojaviti mentalni poremećaji, gubitak trenutnog pamćenja i promjene osobnosti.
Rezimirati: Što trebate učiniti da biste izbjegli trovanje ugljičnim monoksidom? Prije svega, pridržavajte se osnovnih sigurnosnih pravila prilikom loženja peći, ne držite automobil s upaljenim motorom u zatvorenom prostoru, a kuhinje opremljene plinskim štednjacima provjetravajte što češće. Provodite što više vremena na svježem zraku, izbjegavajući hodanje po prometnim autocestama, osobito u blizini prometnih gužvi. Ne propuštajte priliku posjetiti selo, nastojeći kad god je to moguće povećati tjelesnu aktivnost na svježem zraku kako biste aktivno „disali“. I, naravno, nemojte pušiti i ne dopuštajte pušenje u svojoj blizini. I tada podmukli ugljični monoksid neće biti zastrašujući.
Ugljični monoksid ili ugljikov monoksid (CO) je plin bez boje, mirisa i okusa. Gori plavim plamenom, poput vodika. Zbog toga su ga kemičari pomiješali s vodikom 1776. kada su prvi proizveli ugljikov monoksid zagrijavanjem cinkovog oksida s ugljikom. Molekula ovog plina ima jaku trostruku vezu, poput molekule dušika. Zato među njima postoje neke sličnosti: talište i vrelište gotovo su jednaki. Molekula ugljičnog monoksida ima visok potencijal ionizacije.
Kada ugljični monoksid oksidira, nastaje ugljični dioksid. Ova reakcija oslobađa veliku količinu toplinske energije. Zbog toga se ugljični monoksid koristi u sustavima grijanja.
Ugljični monoksid na niskim temperaturama gotovo ne reagira s drugim tvarima, na visokim temperaturama situacija je drugačija. Reakcije adicije raznih organskih tvari odvijaju se vrlo brzo. Mješavina CO i kisika u određenim omjerima vrlo je opasna zbog mogućnosti eksplozije.
Proizvodnja ugljičnog monoksida
U laboratorijskim uvjetima ugljikov monoksid nastaje razgradnjom. Nastaje pod utjecajem vruće koncentrirane sumporne kiseline ili pri prolasku kroz fosforov oksid. Druga metoda je zagrijavanje smjese mravlje i oksalne kiseline na određenu temperaturu. Razvijeni CO može se ukloniti iz ove smjese propuštanjem kroz baritnu vodu (zasićena otopina).
Opasnost od ugljičnog monoksida
Ugljični monoksid je izuzetno opasan za ljude. Uzrokuje teško trovanje i često može uzrokovati smrt. Stvar je u tome što ugljični monoksid ima sposobnost reagirati s hemoglobinom u krvi, koji prenosi kisik do svih stanica u tijelu. Kao rezultat ove reakcije nastaje karbohemoglobin. Zbog nedostatka kisika, stanice doživljavaju gladovanje.
Mogu se identificirati sljedeći simptomi trovanja: mučnina, povraćanje, glavobolja, gubitak vida u boji, respiratorni distres i drugi. Osobi koja se otrovala ugljičnim monoksidom mora se pružiti prva pomoć što je prije moguće. Prvo ga morate izvesti na svježi zrak i staviti mu na nos vatu natopljenu amonijakom. Zatim trljajte prsa žrtve i stavite grijaće jastučiće na noge. Preporuča se dosta tople tekućine. Trebali biste odmah pozvati liječnika nakon otkrivanja simptoma.
Pokušajmo to shvatiti i prisjetimo se znanja iz fizike i kemije.
Ugljični monoksid (ugljični monoksid, ili ugljikov monoksid, kemijska formula CO) je plinoviti spoj koji nastaje izgaranjem bilo koje vrste.
Što se događa kada ova tvar uđe u tijelo?
Nakon ulaska u dišne putove, molekule ugljičnog monoksida odmah završavaju u krvi i vežu se za molekule hemoglobina. Nastaje potpuno nova tvar - karboksihemoglobin, koja ometa transport kisika. Zbog toga se vrlo brzo razvija nedostatak kisika.
Najvažnija opasnost je u tome što je ugljični monoksid nevidljiv i nikako se ne osjeti, nema ni mirisa ni boje, odnosno uzrok bolesti nije očit, nije ga uvijek moguće odmah otkriti. Ugljični monoksid se ne može osjetiti ni na koji način, zbog čega mu je drugo ime tihi ubojica.
Osjećajući umor, nedostatak snage i vrtoglavicu, čovjek čini kobnu pogrešku – odlučuje leći. A, čak i ako kasnije shvati razlog i potrebu izlaska na zrak, u pravilu više nije u stanju učiniti ništa. Mnoge bi moglo spasiti poznavanje simptoma trovanja CO - znajući ih, moguće je na vrijeme posumnjati na uzrok bolesti i poduzeti potrebne mjere za njegovo spašavanje.
Koji su simptomi i znakovi trovanja ugljičnim monoksidom
Ozbiljnost lezije ovisi o nekoliko čimbenika:
– zdravstveno stanje i fiziološke karakteristike osobe. Osjetljiviji na djelovanje CO-a su slabe osobe, kronične osobe, osobito one koje prati anemija, starije osobe, trudnice i djeca;
– trajanje izloženosti CO spoja tijelu;
– koncentracija ugljičnog monoksida u udahnutom zraku;
– tjelesna aktivnost tijekom trovanja. Što je aktivnost veća, to brže dolazi do trovanja.
Tri stupnja ozbiljnosti trovanja ugljičnim monoksidom na temelju simptoma
Blagi stupanj ozbiljnost karakteriziraju sljedeći simptomi: opća slabost; glavobolje, uglavnom u frontalnim i vremenskim regijama; kucanje u hramovima; buka u ušima; vrtoglavica; oštećenje vida - treperenje, točkice pred očima; neproduktivna, tj. suhi kašalj; brzo disanje; nedostatak zraka, otežano disanje; suzenje; mučnina; hiperemija (crvenilo) kože i sluznice; tahikardija; povišen krvni tlak.
Simptomi srednji stupanj ozbiljnost je očuvanje svih simptoma prethodne faze i njihov teži oblik: maglovitost, mogući gubitak svijesti na kratko vrijeme; povraćanje; halucinacije, vizualne i slušne; kršenje vestibularnog aparata, nekoordinirani pokreti; pritiskajući bol u prsima.
Teško trovanje karakteriziraju sljedeći simptomi: paraliza; dugotrajni gubitak svijesti, koma; konvulzije; proširene zjenice; nehotično pražnjenje mjehura i crijeva; povećan broj otkucaja srca do 130 otkucaja u minuti, ali je slabo opipljiv; cijanoza (plava diskoloracija) kože i sluznice; problemi s disanjem - ono postaje plitko i isprekidano.
Atipični oblici trovanja ugljičnim monoksidom
Ima ih dvoje - padanje u nesvijest i euforija.
Simptomi nesvjestice: bljedilo kože i sluznice; smanjen krvni tlak; gubitak svijesti.
Simptomi euforičnog oblika: psihomotorna agitacija; mentalna disfunkcija: delirij, halucinacije, smijeh, čudno ponašanje; gubitak svijesti; respiratorno i srčano zatajenje.
Kako pružiti prvu pomoć žrtvama trovanja ugljičnim monoksidom
Vrlo je važno pravodobno pružiti prvu pomoć, jer vrlo brzo nastaju nepopravljive posljedice.
Prvo je potrebno žrtvu što prije izvesti na svježi zrak. U slučajevima kada je to teško, žrtvi se mora što je prije moguće staviti plinska maska s uloškom od hopkalita i dati joj jastuk za kisik.
Drugo, potrebno je olakšati disanje - osloboditi dišne putove, po potrebi otkopčati odjeću, polegnuti unesrećenog na bok kako bi se spriječilo moguće uvlačenje jezika.
Treće, stimulirajte disanje. Nanesite amonijak, trljajte prsa, zagrijte udove. I što je najvažnije, morate nazvati hitnu pomoć. Čak i ako se na prvi pogled čini da je osoba u zadovoljavajućem stanju, potrebno ju je pregledati liječnik, jer nije uvijek moguće samo po simptomima utvrditi pravi stupanj trovanja. Osim toga, pravodobno započete terapijske mjere smanjit će rizik od komplikacija i smrtnosti od trovanja ugljičnim monoksidom. Ako je stanje žrtve ozbiljno, potrebno je provesti mjere reanimacije do dolaska liječnika.
Kada postoji opasnost od trovanja ugljičnim monoksidom?
Danas se slučajevi trovanja događaju nešto rjeđe nego u ono doba kada su se stambeni prostori grijali pretežno pećima, ali još uvijek postoji dovoljno izvora povećanog rizika. Potencijalni izvori opasnosti od trovanja ugljičnim monoksidom: kuće s pećnim grijanjem, kamini. Nepravilan rad povećava rizik od ulaska ugljičnog monoksida u prostorije, uzrokujući tako izgaranje čitavih obitelji u svojim domovima; kupke, saune, posebno one koje se griju "na crno"; garaže; u industrijama koje koriste ugljični monoksid; dugotrajni boravak u blizini glavnih prometnica; požar u zatvorenom prostoru (dizalo, okno i sl. koje je nemoguće napustiti bez pomoći sa strane).
Samo brojke
- Već pri koncentraciji ugljičnog monoksida od 0,08% javlja se lakši stupanj trovanja - javlja se glavobolja, vrtoglavica, gušenje, opća slabost.
- Povećanje koncentracije CO na 0,32% uzrokuje motoričku paralizu i nesvjesticu. Nakon otprilike pola sata nastupa smrt.
Pri koncentraciji CO od 1,2% i više razvija se fulminantni oblik trovanja - u nekoliko udisaja osoba prima smrtonosnu dozu, smrt nastupa unutar najviše 3 minute.
Ispušni plinovi osobnog automobila sadrže od 1,5 do 3% ugljičnog monoksida. Suprotno uvriježenom mišljenju, možete se otrovati dok motor radi ne samo u zatvorenom prostoru, već i na otvorenom.
- Godišnje se u Rusiji hospitalizira oko dvije i pol tisuće ljudi s različitim stupnjevima ozbiljnosti trovanja ugljičnim monoksidom.
Mjere prevencije
Kako bi se smanjio rizik od trovanja ugljičnim monoksidom, dovoljno je pridržavati se sljedećih pravila:
Upravljajte pećima i kaminom u skladu s pravilima, redovito provjeravajte rad ventilacijskog sustava i pravovremeno čistite dimnjak, a polaganje peći i kamina povjerite samo stručnjacima;
Ne zadržavajte se dugo u blizini prometnih cesta;
Uvijek ugasite motor automobila u zatvorenoj garaži. Potrebno je samo pet minuta rada motora da koncentracija ugljičnog monoksida postane smrtonosna – zapamtite ovo;
Ako dugo boravite u autu, a još više spavate u autu, uvijek ugasite motor
Uzmite si pravilo - ako se pojave simptomi koji upućuju na trovanje ugljičnim monoksidom, što prije osigurajte svježi zrak otvaranjem prozora ili još bolje napustite prostoriju.
Nemojte leći ako osjećate vrtoglavicu, mučninu ili slabost.
Zapamtite – ugljični monoksid je podmukao, djeluje brzo i neprimjetno, pa život i zdravlje ovise o brzini poduzetih mjera. Čuvajte sebe i svoje najmilije!
U hitnim slučajevima možete nazvati jednu hitnu operativnu službu koristeći zaseban broj bilo kojeg mobilnog operatera: to su brojevi 101 (požarna i hitna služba), 102 (policija), 103 (hitna medicinska pomoć), 104 ( plinski servis). mreže)
Jedinstvena telefonska linija za pomoć Glavnog ureda Ministarstva za izvanredne situacije Rusije u regiji Orenburg